LabCorp新冠病毒检测试剂投放市场
据LabCorp®(NYSE:LH)官网消息,位于北卡州的这家全球领先的生命科学公司,已研发出2019新型冠状病毒(COVID-19),NAA测试盒,并于3月6日起接受预定。
美国任何地方的医生或其他授权的医疗服务提供者都可以订购。该测试可检测到引起COVID-19的基础病毒的存在,并用于符合当前评估COVID-19感染指南的患者。
LabCorp总裁兼首席执行官阿丹姆. 斯卡查特(Adam H. Schechter)说:“我们一直致力于尽快提供针对COVID-19的测试,并与政府及其他机构合作解决这一公共卫生危机。”
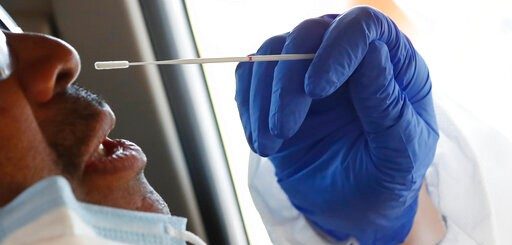
labCorp的科学家在做咽试子实验,这将有助于医生判断新冠病毒 图片源自盖蒂图片社
“通过扩大在美国的检测范围,并准备通过我们的Covance公司的药物开发业务,来支持针对COVID-19的疫苗和治疗方法的开发,我们将履行LabCorp的使命,以改善健康和改善生活。”
虽然这一试剂盒已接受预定,但据LabCorp的实验报告显示,该试剂盒还在等待美国食品药品管理局(FDA)对此独立审查的审批。目前LabCorp拿到的是FDA的紧急状态下的特别授权。
目前的试剂由LabCorp内部开发,并根据美国食品药品管理局(FDA)发布的指南提供。
LabCorp的测试已经过验证,可用于呼吸道样本,包括鼻咽(NP)或口咽(OP)抽吸或清洗,NP或OP拭子以及支气管肺泡灌洗(BAL)。
该测试是使用荧光免疫层析法(PCR)技术的定性分析,近30年前,LabCorp在这项技术的商业化过程中发挥了核心作用。
LabCorp公司强调试剂盒只提供给医生和有授权的医疗服务提供者。公司不直接接受收集样本进行测试。
收集样本工作将由下令进行检查的医疗机构完成,并使用标准程序将样品发送到LabCorp。拿到测试结果需要3-4天。
LabCorp诊断程序首席科学官玛西娅·艾森伯格(Marcia Eisenberg)博士说:“随着COVID-19继续在美国传播,提供高质量,可靠,可扩展的实验室测试是至关重要的部分。
必须确定感染者,以确保患者得到适当的护理,更好地管理和使用医疗资源,并帮助遏制病毒的传播。
我们将继续密切参与正在进行的响应,并准备扩大测试能力,以帮助满足需求。”
根据FDA在2020年2月29日发布的“临床实验室和食品和药物管理局工作人员即时有效指南”,
LabCorp将依照临床试验提升修正案(CLIA)的要求,执行高复杂度测试。同时LabCorp正在寻求欧盟(EUA)的认证。