两款新冠疫苗已开展临床试验,大规模使用得到明年底
本周,一款名为INO-4800的新冠病毒疫苗开始进行一期临床试验,至此美国已有两款新冠病毒疫苗开展一期临床试验。官员和专家表示,美国从研发疫苗到开展一期临床试验的速度创下纪录,但即便一切顺利,疫苗大规模投入使用可能也要等到2021年底。
美国开展临床试验的第一款疫苗是mRNA-1273疫苗,由美国国家过敏症和传染病研究所和莫德纳公司合作研发。mRNA-1273是一种信使核糖核酸(mRNA)疫苗,可针对病毒的刺突蛋白发挥作用。刺突蛋白是病毒感染宿主细胞的关键所在,也是过去研发严重急性呼吸综合征(SARS)冠状病毒疫苗和中东呼吸综合征(MERS)冠状病毒疫苗时的靶点。
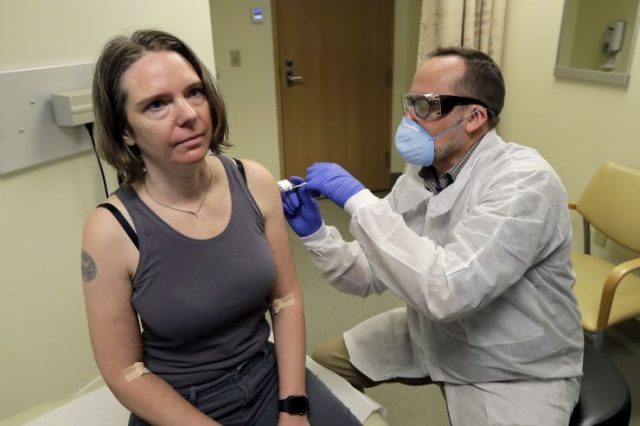
Jennifer Haller(左)16日在西雅图接受首支试验性新冠病毒疫苗注射。(图片来源:美联社)
传统疫苗通常使用灭活病毒方式研制,而mRNA-1273疫苗是由体外合成病毒相关mRNA序列研发而成。3月16日,mRNA-1273疫苗的临床试验在位于西雅图的凯撒医疗集团华盛顿卫生研究所开始实施。莫德纳公司表示,从选择疫苗的mRNA序列到首名志愿者完成疫苗注射只花了63天。
按计划,45名年龄在18岁至55岁之间的健康志愿者参与mRNA-1273疫苗一期临床试验,接受间隔约28天的两次疫苗手臂肌肉注射。他们分为3组,接受注射剂量分别为每次25微克、100微克和250微克,以便评估不同剂量的安全性以及其激发人体免疫反应的能力。志愿者在完成两次疫苗注射后将接受为期一年的观察。
INO-4800疫苗由美国伊诺维奥制药公司研发,是一种DNA(脱氧核糖核酸)疫苗,使用了被称为质粒的一小段病毒环状DNA片段,注射后能使细胞产生病毒的蛋白,从而激发免疫反应,安全性和可靠性较高。
4月6日,INO-4800疫苗一期临床试验在位于费城的宾夕法尼亚大学医学院和位于堪萨斯城的药物研究中心同时展开,共有40名成年健康志愿者参与。志愿者将间隔4周接受两剂疫苗注射。伊诺维奥制药公司表示,疫苗安全性及其激发的免疫反应等数据预计在今年夏末公布。
多名美国专家在接受新华社记者采访时强调,疫苗进入一期临床试验的门槛并不高,但评估其安全性和有效性会持续相当长时间,乐观估计疫苗大规模投入使用也要等到2021年底。
加利福尼亚大学圣迭戈分校传染病系主任罗伯特·斯库利说,候选疫苗进入一期临床试验相对容易,需要满足的条件是能够将病毒蛋白送入免疫系统的关键部位,使免疫系统能识别病毒,这可通过使用病毒蛋白、灭活或减活病毒、病毒RNA或DNA实现。
斯库利说,在一期和二期临床试验对候选疫苗的安全性、其诱导的免疫反应进行评估后,效果显著的疫苗将进入规模较大的三期临床试验,评估其降低感染率和致病严重程度的有效性,这个时间通常需要一年以上。
斯库利说,疫苗从开始研发到美国食品和药物管理局批准上市,整个过程通常需要两年以上时间,具体时长取决于病毒传播的严重程度和疫苗试验的有效性。病毒感染率越高,疫苗试验效果越好,其审批时间越短。
随着白宫8日批准佛蒙特州进入“重大灾难状态”,美国新冠肺炎的“灾情”地图已扩大到至少45个州以及首都华盛顿特区。
据美国约翰斯·霍普金斯大学8日晚10时数据,美国已有超过43.2万人感染新冠肺炎,死亡14817人。其中纽约确诊15.1万人、新泽西确诊4.7万人、密歇根确诊2万人、加利福尼亚确诊1.8万人。
中新社报道,总统特朗普8日在白宫发布会上表示,从5月份开始,美国将有约3亿只口罩陆续交付,并将根据需要再额外订购2亿只作为储备。截至8日,美国政府已分发逾8000台呼吸机,另有1万台准备交付。
对于何时重启经济,特朗普表示,必须等到疫情曲线处于明显下行区间,届时将根据卫生专家等专业人士意见作出决定。