快讯|美国FDA批准首款“生物标志物抗癌疗法”,人类医疗史里程碑!
5月23日,美国FDA传来一条重量级消息——由默沙东公司带来的KEYTRUDA药物获得批准!这是美国FDA批准的首款不依照肿瘤来源,而是依照生物标志物进行区分的抗肿瘤疗法,具有里程碑式的意义。这是可谓是“治疗理念的一小步,抗击肿瘤的一大步!”
生物标志物抗肿瘤疗法
生物标志物通常是指某一种特定的遗传标记。在基础生物医学界,几十年来,研究者们一直都坚信如果可以确认这些"生物标记物",便能找到治愈癌症的方法!通过不断努力,一个又一个的“生物标记物”被科学家们发现。但,实际用到癌症病人身上,还从来没有实现过。
这次,获得批准KEYTRUDA药物就一个依照生物标志物进行区分的抗肿瘤疗法。
KEYTRUDA药物可以治疗携带两种常见的遗传异常现象MSI-H与dMMR的癌症病人。含有这两种变异的肿瘤,细胞内的DNA修复机制往往会受到影响,不能正常发挥作用。这些肿瘤分布非常广泛,可出现在结直肠、子宫内膜、胃肠道、乳腺、前列腺、膀胱、甲状腺等多个部位。

▲美国FDA肿瘤卓越中心负责人Richard Pazdur博士(图片来源:FDA)
这对整个癌症患者群体是重要的‘第一次’,”美国FDA Richard Pazdur博士说道:今天之前,癌症的治疗方法取决于癌症在体内部位。肺癌疗法治肺癌,乳腺癌疗法治疗乳腺癌。但在今天,FDA批准了一款基于肿瘤的生物标志物,而无关肿瘤原发部位的新药。
今日,这样一个一直以来只是“纸上谈兵”的梦终于实现了!
KEYTRUDA怎么抗癌?
本次获批成为首款依照生物标志物进行癌症治疗的新药是由默沙东研发的重磅免疫疗法药物KEYTRUDA。作为一款抗PD-1抗体,KEYTRUDA能抑制人体内的PD-1/PD-L1通路,帮助人体的免疫系统对抗癌症细胞。
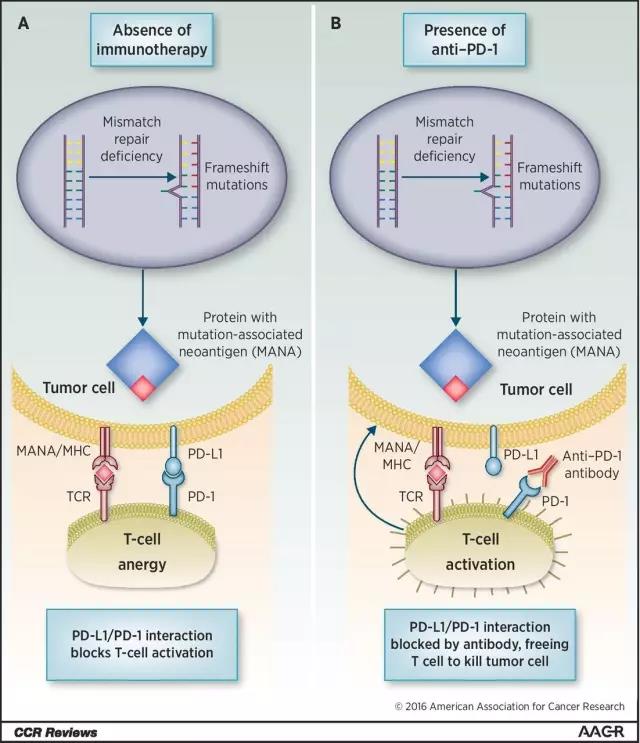
▲肿瘤免疫疗法对带有特定遗传变异的肿瘤有着很好的疗效(图片来源:《Clinical Cancer Research》)
KEYTRUDA的获批是基于一项有149名患者参与的临床试验。这些患者有不同种类肿瘤(15种类型),但都携带生物标记物变异,即是MSI-H或dMMR变异。
在该试验中,患者的客观缓解率(objective response rate)达到了39.6%。其中,部分缓解者有48人,完全缓解者有11人。在出现缓解的患者中,缓解时长超过半年比例超过了78%。值得关注的是,KEYTRUDA在多种实体瘤中都体现了良好的效果——在90名结直肠癌患者中,它的客观缓解率为36%。而在剩下的14种癌症患者中,它的客观缓解率有46%。
基于这些数据,美国FDA加速批准KEYTRUDA上市,治疗带有MSI-H或dMMR变异的实体瘤患者。
历史意义
这是精准医学的胜利,也标志着人类对癌症的认识水平抵达了一个新阶段。“同病异治”,“异病同治”等精准医学的概念,将在未来得到进一步推广。我们恭喜默沙东的KEYTRUDA再创佳绩,并祝愿在精准医学的大旗下,越来越多的新药能给患者带来更好的治疗。
注解:
**microsatellite instability-high,MSI-H
**mismatch repair deficient,dMMR
参考资料:
[1] FDA approves first cancer treatment for any solid tumor with a specific genetic feature [2] FDA grants accelerated approval to pembrolizumab for first tissue/site agnostic indication药明康德