快訊|美國FDA批准首款「生物標誌物抗癌療法」,人類醫療史里程碑!
5月23日,美國FDA傳來一條重量級消息——由默沙東公司帶來的KEYTRUDA藥物獲得批准!這是美國FDA批准的首款不依照腫瘤來源,而是依照生物標誌物進行區分的抗腫瘤療法,具有里程碑式的意義。這是可謂是「治療理念的一小步,抗擊腫瘤的一大步!」
生物標誌物抗腫瘤療法
生物標誌物通常是指某一種特定的遺傳標記。在基礎生物醫學界,幾十年來,研究者們一直都堅信如果可以確認這些”生物標記物”,便能找到治癒癌症的方法!通過不斷努力,一個又一個的「生物標記物」被科學家們發現。但,實際用到癌症病人身上,還從來沒有實現過。
這次,獲得批准KEYTRUDA藥物就一個依照生物標誌物進行區分的抗腫瘤療法。
KEYTRUDA藥物可以治療攜帶兩種常見的遺傳異常現象MSI-H與dMMR的癌症病人。含有這兩種變異的腫瘤,細胞內的DNA修復機制往往會受到影響,不能正常發揮作用。這些腫瘤分布非常廣泛,可出現在結直腸、子宮內膜、胃腸道、乳腺、前列腺、膀胱、甲狀腺等多個部位。

▲美國FDA腫瘤卓越中心負責人Richard Pazdur博士(圖片來源:FDA)
這對整個癌症患者群體是重要的『第一次』,」美國FDA Richard Pazdur博士說道:今天之前,癌症的治療方法取決於癌症在體內部位。肺癌療法治肺癌,乳腺癌療法治療乳腺癌。但在今天,FDA批准了一款基於腫瘤的生物標誌物,而無關腫瘤原發部位的新葯。
今日,這樣一個一直以來只是「紙上談兵」的夢終於實現了!
KEYTRUDA怎麼抗癌?
本次獲批成為首款依照生物標誌物進行癌症治療的新葯是由默沙東研發的重磅免疫療法藥物KEYTRUDA。作為一款抗PD-1抗體,KEYTRUDA能抑制人體內的PD-1/PD-L1通路,幫助人體的免疫系統對抗癌症細胞。
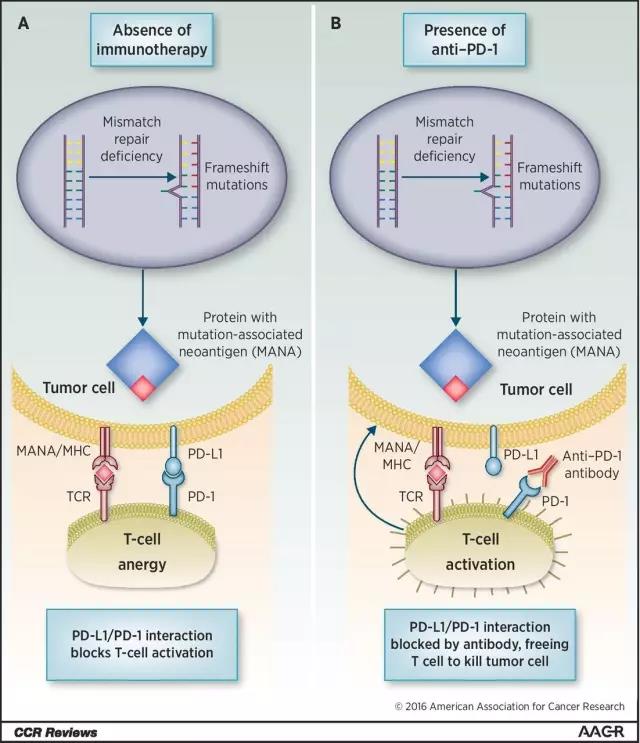
▲腫瘤免疫療法對帶有特定遺傳變異的腫瘤有著很好的療效(圖片來源:《Clinical Cancer Research》)
KEYTRUDA的獲批是基於一項有149名患者參與的臨床試驗。這些患者有不同種類腫瘤(15種類型),但都攜帶生物標記物變異,即是MSI-H或dMMR變異。
在該試驗中,患者的客觀緩解率(objective response rate)達到了39.6%。其中,部分緩解者有48人,完全緩解者有11人。在出現緩解的患者中,緩解時長超過半年比例超過了78%。值得關注的是,KEYTRUDA在多種實體瘤中都體現了良好的效果——在90名結直腸癌患者中,它的客觀緩解率為36%。而在剩下的14種癌症患者中,它的客觀緩解率有46%。
基於這些數據,美國FDA加速批准KEYTRUDA上市,治療帶有MSI-H或dMMR變異的實體瘤患者。
歷史意義
這是精準醫學的勝利,也標誌著人類對癌症的認識水平抵達了一個新階段。「同病異治」,「異病同治」等精準醫學的概念,將在未來得到進一步推廣。我們恭喜默沙東的KEYTRUDA再創佳績,並祝願在精準醫學的大旗下,越來越多的新葯能給患者帶來更好的治療。
註解:
**microsatellite instability-high,MSI-H
**mismatch repair deficient,dMMR
參考資料:
[1] FDA approves first cancer treatment for any solid tumor with a specific genetic feature [2] FDA grants accelerated approval to pembrolizumab for first tissue/site agnostic indication葯明康德