稱中國產N95型口罩不達標 FDA取消對數十家公司授權
美國監管機構周四以性能不合格為由,禁止數十家中國公司將所生產的N95型口罩出口至美國,並警告醫療健保提供商在使用這些列入黑名單的產品時要重新考慮。
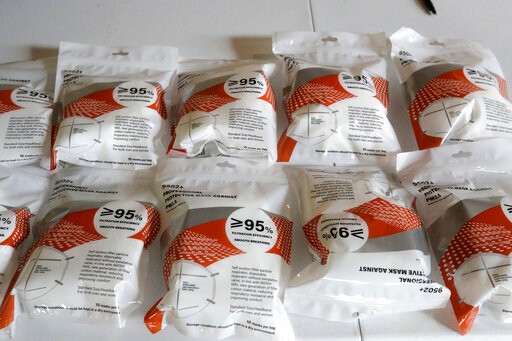
根據文件,美國食品藥品監督管理局(FDA)認定,許多中國製造的N95類型口罩不達標,所過濾的顆粒物不足95%,將授權的製造商數量從86將至14個。
N95口罩比布面罩或外科口罩能更好地防止新冠病毒顆粒,在醫療保健提供者和急救人員中需求極高。4月3日,N95口罩的嚴重短缺導致FDA允許從中國進口類似口罩。
這些進口口罩(稱為KN95)未經過美國監管機構的測試,但必須由認可的實驗室進行化驗抽檢,證明它們符合疾病控制與預防中心(CDC)的標準,即過濾95%的包括新冠病毒在內的0.3微米或更大的顆粒。
作為額外的保障措施,CDC和FDA發起了自己的審查,以確保口罩符合這些性能標準。但在周四,FDA稱,太多的中國進口產品未能過濾出足夠比例的顆粒。檢測結果表明,許多被授權在美國銷售口罩的公司都不符要求,其中一種產品的過濾效果僅為24%至35%。衛生機構還檢測了一些未經機構批准的KN95口罩。據FDA稱,有一種口罩僅阻止了大約1%的粒子。
對中國製造的「過濾式口罩呼吸器」保有出口權的公司包括明尼蘇達州的3M公司和中國深圳的比亞迪,後者在加州生產電池供電的巴士。
FDA「正在加強對從中國進口的所有呼吸器進行監視和採樣,所有從中國進口到美國的呼吸器將經由(美國職業安全與健康研究所)隨機採樣和檢測,以確定呼吸器符合95%的微粒過濾標準。」
不在FDA認可的製造商名單上的中國產呼吸器仍可以作為普通口罩使用。