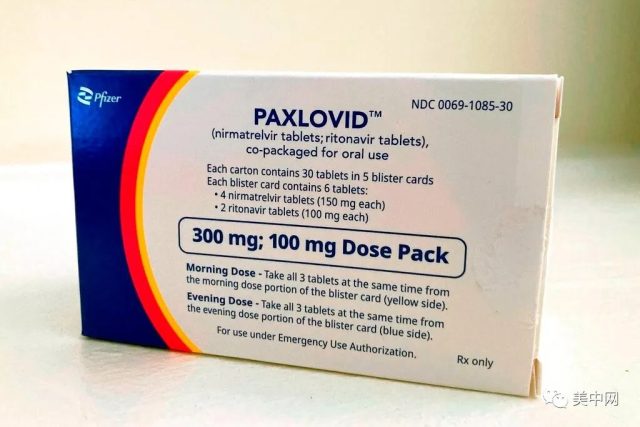
FDA”完全批准”輝瑞的新冠口服藥Paxlovid
食品和藥物管理局(FDA)周四「完全批准」了輝瑞(Pfizer)公司的抗新冠病毒口服藥Paxlovid。NBC新聞稱,FDA這一最新決定意味著,現在有大量臨床數據表明,Paxlovid口服藥是安全、有效的。
根據FDA對輝瑞公司數據的審查,在首次出現新冠癥狀後5天內接受Paxlovid藥物治療的成年人中,住院或死亡風險被降低了86%;在出現癥狀3天內接受治療的成年人中,同等風險降低了89%。
NBC新聞稱,在美國,多達四分之三的成年人處於患新冠重症的高風險中。而Paxlovid葯的最主要受眾是50歲以上有輕度至中度新冠癥狀的人群,以及因既往病史而成為新冠高風險重症患者的人,後者往往患有糖尿病、心臟病、癌症或免疫系統較弱。
2021年12月,FDA首次允許12歲及以上高危人群在緊急授權下可使用Paxlovid治療。該治療包括兩種藥物:尼馬曲韋(nirmatrelvir)和利托那韋(ritonavir),前者用以阻斷新冠病毒複製所需的一種關鍵酶,後者用以增強前者對抗感染的能力。
輝瑞和FDA都將這種治療視為新冠疫苗接種的重要補充,可幫助高危患者控制其感染並最終挽救生命。
FDA研究人員根據1月份的數據估計,Paxlovid葯可在美國「每周挽救1500人的生命並避免1.3萬人住院」。
目前,政府在全美範圍內提供了110萬個該葯的免費療程。一旦免費藥用完,政府將把該葯的分銷轉移到商業市場。這意味著輝瑞公司將以尚未披露的價格將該葯直接出售給醫療保健提供商。
目前Paxlovid的每療程定價約為530元。NBC新聞稱,輝瑞的此葯銷售額在2022年躍升至近190億元,預計隨著疫情的結束,2023年該葯帶來的收入將下降58%。