LabCorp新冠病毒檢測試劑投放市場
據LabCorp®(NYSE:LH)官網消息,位於北卡州的這家全球領先的生命科學公司,已研發出2019新型冠狀病毒(COVID-19),NAA測試盒,並於3月6日起接受預定。
美國任何地方的醫生或其他授權的醫療服務提供者都可以訂購。該測試可檢測到引起COVID-19的基礎病毒的存在,並用於符合當前評估COVID-19感染指南的患者。
LabCorp總裁兼首席執行官阿丹姆. 斯卡查特(Adam H. Schechter)說:「我們一直致力於盡快提供針對COVID-19的測試,並與政府及其他機構合作解決這一公共衛生危機。」
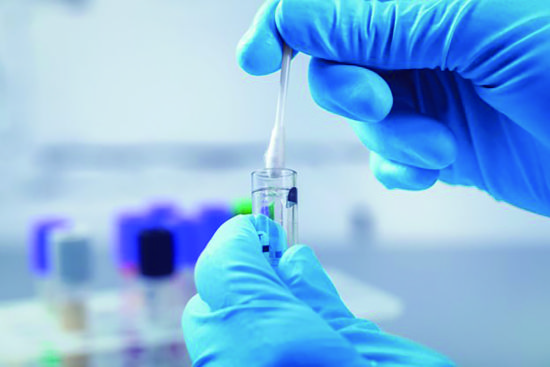
labCorp的科學家在做咽試子實驗,這將有助於醫生判斷新冠病毒 圖片源自蓋蒂圖片社
「通過擴大在美國的檢測範圍,並準備通過我們的Covance公司的藥物開發業務,來支持針對COVID-19的疫苗和治療方法的開發,我們將履行LabCorp的使命,以改善健康和改善生活。」
雖然這一試劑盒已接受預定,但據LabCorp的實驗報告顯示,該試劑盒還在等待美國食品藥品管理局(FDA)對此獨立審查的審批。目前LabCorp拿到的是FDA的緊急狀態下的特別授權。
目前的試劑由LabCorp內部開發,並根據美國食品藥品管理局(FDA)發布的指南提供。
LabCorp的測試已經過驗證,可用於呼吸道樣本,包括鼻咽(NP)或口咽(OP)抽吸或清洗,NP或OP拭子以及支氣管肺泡灌洗(BAL)。
該測試是使用熒光免疫層析法(PCR)技術的定性分析,近30年前,LabCorp在這項技術的商業化過程中發揮了核心作用。
LabCorp公司強調試劑盒只提供給醫生和有授權的醫療服務提供者。公司不直接接受收集樣本進行測試。
收集樣本工作將由下令進行檢查的醫療機構完成,並使用標準程序將樣品發送到LabCorp。拿到測試結果需要3-4天。
LabCorp診斷程序首席科學官瑪西婭·艾森伯格(Marcia Eisenberg)博士說:「隨著COVID-19繼續在美國傳播,提供高質量,可靠,可擴展的實驗室測試是至關重要的部分。
必須確定感染者,以確保患者得到適當的護理,更好地管理和使用醫療資源,並幫助遏制病毒的傳播。
我們將繼續密切參與正在進行的響應,並準備擴大測試能力,以幫助滿足需求。」
根據FDA在2020年2月29日發布的「臨床實驗室和食品和藥物管理局工作人員即時有效指南」,
LabCorp將依照臨床試驗提升修正案(CLIA)的要求,執行高複雜度測試。同時LabCorp正在尋求歐盟(EUA)的認證。