狗是新冠中間宿主?研究稱病毒在狗腸道進化後傳人
自從新冠肺炎COVID-19暴發以來,全世界越來越多的實驗團隊加入溯源隊伍,試圖了解引發這次疫情的新型冠狀病毒如何從動物宿主傳染給人類。截至目前,該疫情已造成全球確診患者超過190萬人,累計死亡超過12萬人。
目前普遍認可的是,新冠病毒或來源於蝙蝠,其和中科院武漢病毒所石正麗研究員團隊2013年在中國雲南採集的RaTG13樣本的相似性為96.2%。然而,科學家們仍一直在尋找介於蝙蝠和首次將新冠病毒病毒引入人類之間的中間宿主,蛇、穿山甲此前都被納入「疑似名單」。
最新的一份研究將該名單再補充一員——狗。當地時間4月14日,國際權威期刊《分子生物學和進化》(Molecular Biology and Evolution,其2018/2019影響因子為14.797)雜誌在線發表了一項研究,給出一種全新的推測:狗或許是將新冠傳染給人類的中間宿主,病毒可能在狗的腸道中進化,從而獲得了感染人的能力。
該研究僅有一名作者,也是該論文的通訊作者,為加拿大渥太華大學生物學教授夏旭華(Xuhua Xia)。官網介紹顯示,夏旭華實驗室的研究集中在脊椎動物線粒體作為具有三個基本生物過程的簡化生物系統;宿主-寄生蟲在分子水平上的相互作用,特別是通過基因組重組和水平基因轉移控制新的病毒和細菌性病原體起源的機制;微生物基因組進化;可變剪接的起源和進化;開發強大的計算工具。
夏旭華總結,他這項研究的結果為新冠病毒的起源和最初傳播提供了假設。首先,新冠病毒和蝙蝠來源冠狀病毒RaTG13的祖先感染了一種哺乳動物的腸道(例如犬科動物或人類食用的蝙蝠肉)。第二,犬類腸病毒RNA基因組對CpG的強選擇性可能導致病毒的快速進化,大量CpG到UpG 的突變導致基因組ICpG和GC%的減少。第三,犬類在交配和其他情況下會舔舐肛門區域,幫助病毒從消化系統傳播到呼吸系統。最後,減少的病毒基因組ICpG使病毒逃避人類ZAP介導的免疫應答,成為一種嚴重的人類病原體。
他強調,這表明,在與新冠病毒的鬥爭中,監測野狗體內SARS樣冠狀病毒的重要性。
不過,夏旭華的這份推論目前已引發了多名學者公開質疑。
抗病毒前哨蛋白:ZAP
包括蝙蝠在內的野生哺乳動物物種構成了冠狀病毒(包括SARS、MERS和致命的新冠病毒)的天然宿主。論文中提到,不同的宿主或宿主組織提供不同的細胞環境,特別是不同的抗病毒和RNA修飾活動,這些可以改變病毒RNA基因組中觀察到的RNA修飾特徵。
其中,鋅指抗病毒蛋白(ZAP)是哺乳動物干擾素介導免疫應答的關鍵成分,其RNA結合域與病毒RNA基因組中的CpG二核苷酸特異性結合。ZAP可抑制病毒複製,並介導病毒基因組降解。因此,ZAP的作用就類似於抗病毒前哨蛋白。
ZAP不僅可以對抗HIV-1這樣的逆轉錄病毒,還可以對抗埃柯病毒7型和寨卡病毒等,後兩種病毒都是正義單鏈RNA病毒,類似冠狀病毒。特別是,在ZAP缺陷細胞中,針對病毒RNA中CpG的選擇消失了。論文中提到,這表明ZAP可能是唯一針對病毒RNA基因組中CpG的細胞因子。
實際上,許多哺乳動物RNA病毒已經進化出CpG缺陷。此前的研究顯示,在ZAP存在的情況下,在這些低CpG病毒基因組中增加CpG二核苷酸始終會導致病毒複製和毒力下降。這也促使提出了涉及增加CpG以減弱致病性RNA病毒的疫苗開發策略。
作者引用了此前的一些認為,病毒RNA基因組中CpG的減少與毒性增強之間存在關聯。在RNA病毒中,CpG下降與毒力增強之間的聯繫主要是由於干擾素誘導的ZAP蛋白通過其RNA結合域與病毒RNA基因組中的CpG二核苷酸結合,抑制病毒複製,促進病毒基因組降解。
基於此,作者提到,病毒病原體中ICpG的減少意味著對公共衛生的威脅增加,但ICpG的增加減少了這種威脅,因為這類病毒病原體,隨著ICpG的增加和毒力的降低,將類似於自然疫苗。「事實上,許多病毒研究人員已經提出通過增加病毒RNA基因組中的CpG來開發疫苗。」
鑒於ZAP表現出組織特異性表達,因此感染不同組織的病毒可能具有不同的CpG信號,「這為識別病毒宿主組織轉換提供了一種方法。」
新冠病毒及其最接近的RaTG13的ICpG水平在其譜系中最低
在這項研究中,夏旭華檢測了存入GenBank 中的1252個β冠狀病毒全長基因組。GenBank是美國國家生物技術信息中心(NCBI)建立的DNA序列資料庫,包含了來自所有可獲得的公共來源的DNA序列。
結果顯示,新冠病毒及其最接近的已知近親RaTG13(中科院武漢病毒所石正麗研究員團隊2013年在中國雲南採集)的ICpG水平在其譜系中最低,兩者都是病毒基因組ICpG與GC%的異常值。
作者表示,可以看出,在同一宿主的不同病毒譜系之間,或在同一病毒譜系的不同宿主之間,基因組GC%和ICpG都存在差異。
作者認為,最引人注目的是,RaTG13 譜系中的病毒基因組CpG產生了一個孤立且急劇的下降。在此次疫情暴發之後,石正麗團隊研究顯示,RaTG13和新冠病毒的序列相似性為96.2%。
作者在論文寫道:不幸的是,RaTG13在2013年沒有被測序,否則ICpG的下降可能是一個警告,因為有兩個非常重要的含義。
首先,該病毒可能是在一個ZAP高表達的組織中進化而來,ZAP高表達有利於ICpG低的病毒基因組。第二,更重要的是,病毒的存活表明它已經成功地避開了ZAP介導的抗病毒防禦。「換句話說,這種病毒已經變得鬼鬼祟祟,對人類很危險。」
此次檢測得出,RaTG13基因組的ICpG值為0.40875,遠低於從菊頭蝠屬蝙蝠物種採集的所有其他β冠狀病毒基因組中觀察到的ICpG值。在不同的病毒譜系基因組ICpG會有波動,但只有RaTG13 ICpG被觀察到有一個非常低的值。
作者提到,這表明RaTG13和新冠病毒的祖先可能在有高表達ZAP的哺乳動物組織中進化,從而產生異常低的ICpG。這種哺乳動物組織可能不在菊頭蝠體內,因為在其他蝙蝠家族中沒有發現ICpG含量較低的情況。
他認為,如果能鑒定出ICpG含量相對較低的病毒,就意味著候選宿主物種的組織細胞環境對病毒基因組中的CpG有很強的選擇性。
犬冠狀病毒:新冠病毒或來源於狗?
截至2020年2月3日,GenBank提供的所有β冠狀病毒中,有1127個獨特基因組,其中927個基因組有明確的宿主名稱。但作者提到,令人驚訝的是,不同自然宿主中沒有可用的β冠狀病毒基因組具有與新冠病毒和RaTG13相近的基因組ICpG和GC%組合。
為了尋找一種有可能選擇ICpG值較低的病毒譜系的哺乳動物宿主,作者擴展了搜索範圍,將所有完整的α冠狀病毒病毒基因組都納入研究中。其基因組測試範圍包含了人類經常接觸的寵物貓狗,牛、馬、羊和豬等牲畜,還有刺蝟、老鼠,也包括長頸鹿和非洲大羚羊等野生動物。
搜索範圍擴大後,作者發現,只有來自犬冠狀病毒(CCoVs)的基因組,具有與新冠病毒和RaTG13相似的基因組ICpG和GC%值。犬冠狀病毒在世界範圍內導致了犬類的高度傳染性腸道疾病,其中最致命的、入侵多個犬類器官的泛嗜熱病毒CCoV基因組,屬於觀察到的ICpG值最低的一個分支。
作者認為需要強調的是,犬科動物,像駱駝一樣,也有冠狀病毒感染它們的呼吸系統。CRCoV有兩個基因組序列,它們的基因組ICpG值分別為0.4756和0.4684,顯著高於感染消化系統的CCoVs。因此,與感染駱駝的冠狀病毒相似,感染犬消化系統的CCoVs的ICpG含量遠低於感染犬呼吸系統的CRCoVs。
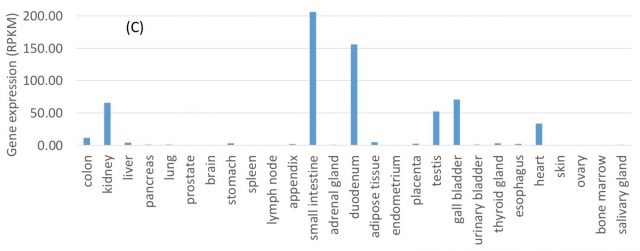
目前的研究認為,新冠病毒進入細胞的細胞受體是ACE2(血管緊張素轉化酶2)。ACE2在人類消化系統中廣泛表達,在小腸和十二指腸中表達水平最高,在肺中表達相對較低。這表明哺乳動物的消化系統很可能被冠狀病毒感染。
作者認為,最近的一份報告進一步證實了這一解釋,即大部分COVID-19患者也有消化不適。
作者在論文中總結道,這些觀察結果為新冠病毒的起源和最初傳播提供了假設。首先,新冠病毒和蝙蝠來源冠狀病毒RaTG13的祖先感染了一種哺乳動物的腸道(例如犬科動物或人類食用的蝙蝠肉)。第二,犬類腸病毒RNA基因組對CpG的強選擇性可能導致病毒的快速進化,大量CpG到UpG 的突變導致基因組ICpG和GC%的減少。第三,犬類在交配和其他情況下會舔舐肛門區域,幫助病毒從消化系統傳播到呼吸系統。最後,減少的病毒基因組ICpG使病毒逃避人類ZAP介導的免疫應答,成為一種嚴重的人類病原體。
他強調,這表明,在與新冠病毒的鬥爭中,監測野狗體內SARS樣冠狀病毒的重要性。
學界質疑
然而,該論文雖經過同行評議正式刊發,但卻引來諸多質疑。質疑聲普遍認為,這僅僅是一種假設,基於對各種冠狀病毒基因組的計算機分析,一種尚未被任何既定事實證明的理論。英國劍橋大學獸醫學系主任James Wood教授說,「我不認為任何狗主人會因為這項研究而感到擔憂。」他認為,沒有在這篇論文中看到任何支持這一假設的東西,「有太多的推論和太少的直接數據。」
美國范德比爾特大學醫學院的預防醫學和傳染病教授、傳染病專家William Schaffner不禁提問,「我們是應該擔心從我們的狗身上感染病毒,還是應該擔心把病毒傳染給我們的狗?」他認為,這兩個問題的答案都是否定的。
「這項研究是在沒有任何新數據的情況下對舊數據進行重新分析的基礎上進行的。」得克薩斯農工大學生物科學系主任Ben Neuman補充說,這項研究與之前一篇錯誤地將蛇認為是新冠病毒起源的論文有相似之處,「需要一些新的數據來最終解開新冠病毒的起源之謎,貓或狗是新冠病毒的中間宿主的結論是高度推測性的,不應該作為事實提出。」
同樣,來自美國舊金山州立大學生態學和進化學專家Pleuni Pennings也認為夏旭華這篇論文中的一些數據和結論並不能成立。Pennings的團隊已經檢測了許多病毒的CpG水平,她認為這項研究的邏輯有弱點。
Pennings於2018年發表在PLOS Genetics雜誌上的一項研究中調查了HIV病毒的CpG水平,並研究了這種病原體在人體內的進化過程。她也領導了類似的研究,研究其他幾種病毒,包括登革熱病毒、流感病毒、乙型和丙型肝炎病毒,了解這些病毒通過突變失去或獲得CpG位點的頻率。
Pennings說,產生CpG突變對病毒來說可能代價高昂,因為它們會提醒身體受到感染,所以隨著時間的推移,進化力量會使它們最小化。「有許多病毒的CpG值低於新冠病毒,」她說,「當你觀察所有的病毒時,CpG值一點也不奇怪。」
她補充說,夏旭華的這項研究確實發現了新冠病毒比其他動物傳播的冠狀病毒含有更少的CpG位點,並且假設這一發現是正確的,那麼這就提出了為什麼會出現這種情況的問題。Pennings說,即使有進化上的原因可以解釋為什麼新冠病毒失去了CpG位點,進化上的原因也不能使這種病毒在感染人類方面具有特殊優勢。
針對夏旭華在論文中指出,「研究顯示出病毒RNA基因組中CpG的減少與毒性增強之間的聯繫」,這意味著低CpG病毒似乎與更嚴重的感染有關。然而,Pennings提醒,CpG位點數量少的病毒一定更致命。她舉例說,BK病毒含有很少的CpG位點,大約60%到80%的成年人的腎臟中都有這種病毒,但通常只會在免疫抑制的人身上引發癥狀。
另外還有值得注意的是,目前已有的一些研究也似乎並不支持狗在這場疫情中發揮重要作用。此前的當地時間4月8日,頂級學術期刊《科學》(Science)在線發表了中國科學院院士、中國農科院哈爾濱獸醫研究所動物流感基礎與防控研究創新團隊首席科學家陳化蘭,以及中國農業科學院哈爾濱獸醫研究所所長、國家動物疫病防控高級別生物安全實驗室主任步志高等人的一項研究,他們通過在P4(生物安全等級四級)實驗室中進行的一系列新冠病毒感染試驗發現,新冠病毒在狗、豬、雞和鴨子身上複製效果不佳,但在雪貂和貓身上卻很有效。他們還發現病毒可以通過呼吸道飛沫在貓之間傳播。
實際上,新冠疫情以來,從事病毒溯源工作的一些實驗團隊陸續將蛇、穿山甲、貓等動物納入了新冠病毒的疑似中間宿主名單。然而,截至目前,仍然沒有一種令人信服的結論得出。